TALLER: "Métricas en la Elección de un Proceso Verde"
Fecha: Miércoles 29 de octubre
Lugar: Aula 12
Horario: 16:30 a 18:30 hs.
Asiste toda la comisión
Se puede obtener la fotocopia de la Guía en la fotocopiadora "Carlitos" en Suipacha 579.
miércoles, 22 de octubre de 2014
Taller: Métricas en la elección de un proceso verde
El creciente interés a nivel mundial en el
impacto medioambiental producto de las distintas actividades humanas ha
conducido a la búsqueda de soluciones más “verdes”, y aquellos que hayan sido
capacitados en Química Verde estarán en mejores condiciones para hacer frente a
estos problemas. En este contexto, es esencial el desarrollo de ejercicios que
permitan a los alumnos pensar de manera crítica y proporcionarles las herramientas
para elegir “la más verde” de dos o más opciones.
Las métricas tales como Economía de Átomo (AE, Atom Economy) y el Factor-E (E, Environmental factor) son comúnmente usadas para
evaluar cuan verde es un proceso. Una ventaja que presentan estas métricas es
la simplicidad de su cuantificación, aunque en algunos casos no brindan
suficiente información para la selección de un proceso verde. Existen otros
tipos de métricas, tales como aquellas usadas en el Análisis del Ciclo de Vida (LCA, Life Cycle Assesment), que son más
informativas respecto al impacto medioambiental. El LCA es una técnica para
evaluar los aspectos ambientales y los impactos potenciales a lo largo de la
vida de un producto desde la adquisición de la materia prima, pasando por la
producción, el uso y la eliminación. La estructura general, los principios y
los requisitos para conducir y reportar estudios de LCA están establecidos en
la Norma ISO 14040:2000.
Las métricas de impacto medioambiental basadas
en la estrategia ISO LCA que fueron elegidas para el análisis de este ejercicio
son las siguientes:
-
Potencial de acidificación (AP, Acidification Potential):
potencial de un compuesto gaseoso de generar lluvia ácida.
-
Potencial de agotamiento de
ozono (ODP, Ozone
Depletion Potential): mide la capacidad de un compuesto halogenado gaseoso o
muy volátil de destrucción de la capa de ozono.
- Potencial de formación de smog (SFP, Smog Formation Potential):
mide la habilidad de un compuesto químico orgánico volátil de contribuir a la
formación de smog.
- Potencial de calentamiento
global (GWP, Global
Warning Potential): es una medida de la capacidad de un compuesto químico
gaseoso o volátil de contribuir al calentamiento global.
-
Potencial de toxicidad humana
por ingestión
(INGTP, human Toxicity by INGestion Potential).
-
Potencial de Toxicidad humana
por inhalación
(INHTP, human Toxicity by INHalation Potential).
-
Persistencia (PER, PERsistance): tiempo de vida de un
compuesto en suelo,
atmósfera.
-
Bioacumulación
(ACCU, bioACCUmulation): medida de la acumulación de sustancias químicas en
organismos vivos.
-
Potencial de agotamiento de
recursos abióticos
(ADP, Abiotic Depletion Potential): mide el riesgo relativo de agotamiento de
cada elemento.
Cada una de estas métricas se calcula en base
a patrones o referencias. Además para las métricas AP, ODP, SFP, GWP, INGTP,
INHTP y ADP se determina el índice de riesgo respectivo: IAP, IODP, ISFP, IGWP, IINGTP,
IINHTP y IADP,
el cual tiene en cuenta también la masa de compuesto químico liberada al
medioambiente.
Consideraciones
previas del caso bajo estudio.
Los aceites de soja
hidroxilados, también llamados polioles de soja, son compuestos ampliamente
usados en la síntesis de poliuretanos. Estos polioles derivados de aceites
vegetales presentan mayores beneficios medioambientales que aquellos derivados del
petróleo, ya que los primeros reducen significativamente las emisiones de gases
de efecto invernadero.
Los polioles de soja son
obtenidos a partir de los aceites de soja epoxidados vía una apertura de
epóxido catalizada por ácido, la cual emplea metanol como nucleófilo (Figura
1). El aceite de soja epoxidado es muy conocido y comercialmente disponible y
se utiliza como plastificante en la industria de los plásticos.
En términos de química verde, un problema común en
la síntesis de estos metoxihidroxi polioles a partir de aceites epoxidados es
la necesidad de emplear ácidos de Bronsted fuertes para activar el anillo
oxirano hacia el ataque de nucleófilos débiles como el metanol. En
consecuencia, es requerimiento la remoción del ácido, la purificación del
solvente y trabajar a altas temperaturas, lo que genera emisiones gaseosas y
subproductos indeseables como cetonas. A raíz de ello, se han llevado a cabo
investigaciones enfocadas en la utilización de catalizadores ácidos sólidos (zeolitas,
resinas, etc.) los cuales permitirían reemplazar las numerosas toneladas de
catalizadores ácidos homogéneos no reciclables consumidos en los procesos
industriales. Sin embargo, está bajo estudio la selectividad y el rendimiento
de producto empleando este tipo de catalizadores. Por otro lado, en la búsqueda
de soluciones más verdes para este problema, las nanopartículas de Fe/Fe3O4
con residuos ácidos han mostrado especiales ventajas [1]. Por un
lado, estas nanopartículas de Fe permiten reducir la cantidad de catalizador
debido a que tienen una mayor área superficial y por otro, son eficientemente
removidas con un campo magnético.
Descripción
de los métodos a analizar.
Las características generales de los catalizadores analizados
son:
- Ácido sulfúrico. Ácido de Bronsted fuerte. Requiere remoción del ácido, purificación del solvente, alta temperatura. Gran cantidad de emisiones gaseosas.
- Resina Amberlyst-15. Resina ácida. Bajo rendimiento. Mayor consumo energético comparado con catálisis homogénea. Inconveniente en el “hinchado” de la resina. Formación de subproductos (cetonas).
- Resina SAC 13. Resina ácida. Bajo rendimiento. Mayor consumo energético comparado con catálisis homogénea. Inconveniente en el “hinchado” de la resina. Formación de subproductos (cetonas).
- Nanopartículas magnéticas de Fe/Fe3O4 (NP) con residuos ácidos. No deben ser “hinchadas”. Son eficientemente removidas con un campo magnético. Bajo consumo energético.
Rutas
sintéticas evaluadas.
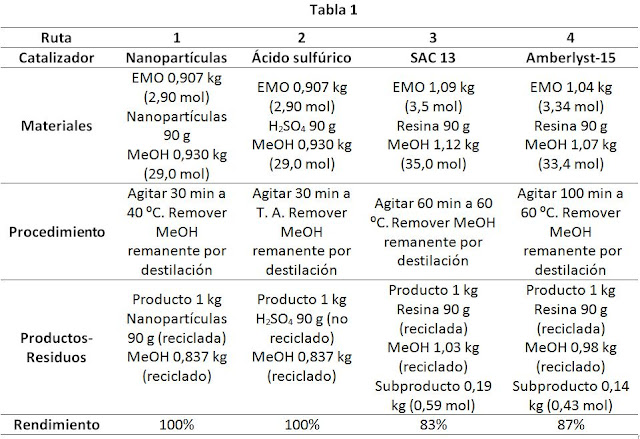
En la Tabla 1 se presentan las
rutas sintéticas que involucran la utilización de los distintos catalizadores,
detallándose los materiales, el procedimiento, los productos, residuos y el
rendimiento en cada caso para la fabricación de 1kg de producto.
Métricas de impacto
medioambiental para las rutas evaluadas.
En la Tabla 2 se presentan para las distintas rutas
los valores obtenidos para los índices de riesgo de las nueve métricas
consideradas. Estos valores pueden ser calculados a partir de expresiones
matemáticas que superan el alcance de este curso [2]


Discusión de
los resultados.
En base al análisis de los
resultados presentados se discutirá en el taller cual de las distintas rutas
evaluadas es la “más verde”. Los alumnos deberán justificar el por qué de su
elección.
Las pautas específicas para la
realización de este trabajo serán presentadas oportunamente durante el
desarrollo de la clase.
Referencias
[1] Mercer,S. M.; Andraos, J.; Jessop, P. G. J. Chem. Educ. 2012, 89, 215−220.
[2] Ahn, K. B.; Wang, H.; Robinson, S.; Shrestha, T. J.; Troyer D. L.; Bossmann, S. H., Sun, X. S. Green Chem., 2012, 14, 136–142.
jueves, 18 de septiembre de 2014
Personajes de la Química
Frederick Sanger 1918- 2013
Quizás a muchos no le suene conocido este nombre pero Frederick Sanger fue la única persona en recibir en dos oportunidades el Premio Nobel de Química.
En 1958 recibió el primer Premio Nobel por su trabajo sobre las estructuras de las proteinas, en particular elucidando la estructura primaria de la insulina.
En 1980 ganó nuevamente el Premio Nobel por sus cruciales desarrollos en la secuenciación de los ácidos nucleicos.
Sus aportes científicos revolucionaron el estudio de los ácidos nucleicos. Su métodos de secuenciación fueron utilizados durante el Proyecto del Genoma Humano en el año 2000.
Otros dos químicos fueron galardonados con dos Premios Nobeles pero en diferentes áreas:
Maria Salomea Skłodowska-Curie
Premio Nobel de Física 1903
Premio Nobel de Química 1911
Linus Carl Pauling
Premio Nobel de Química 1954
Premio Nobel de la Paz 1962
martes, 16 de septiembre de 2014
TRABAJO PRÁCTICO SEMANAS 24-09-2014 y 01-10-2014
Se puede obtener la fotocopia de la guía en la Fotocopiadora de Carlitos, Suipacha 579
El trabajo práctico se llevará a cabo en el laboratorio de Química Orgánica en el CUAS 4
“Introducción a la Química Verde”
El trabajo práctico se llevará a cabo en el laboratorio de Química Orgánica en el CUAS 4
“Introducción a la Química Verde”
Trabajo Práctico:
El objetivo central de este
trabajo práctico consiste en implementar e interpretar los principios y métodos
de la Química Verde en distintas experiencias de laboratorio.
Experiencias
a realizarse:
·
Extracción de D-limoneno de la
cáscara de naranja empleando CO2
·
Oxidación de alcoholes
Experiencia nº 1: “Extracción de D-limoneno
de la cáscara de naranja empleando CO2”
Objetivo:
Extraer el aceite
esencial de la cáscara de naranja (D-limoneno)
empleando CO2 líquido. Observar los cambios de fases del CO2.
Principios
de la Química Verde considerados:
-
Prevención: Es mejor
prevenir la formación de desechos antes que generarlos y luego tratarlos para
su eliminación.
-
Síntesis química
menos peligrosa: Las metodologías sintéticas deberían ser diseñadas para usar y
generar sustancias que no sean tóxicas para la salud humana ni para el
medioambiente.
-
Empleo de
solventes seguros: Deberían emplearse solventes inocuos.
-
Uso de materias
primas renovables
Consideraciones
teóricas:
Los aceites
esenciales son compuestos orgánicos que son extraídos de fuentes naturales y
son empleados en la obtención de numerosos productos de interés como por
ejemplo fragancias, fármacos, cosméticos, insecticidas. El D-limoneno (Figura 1) es el
componente mayoritario del aceite esencial de naranja, el cual se encuentra en
la porción coloreada de la cáscara de naranjas y de otros cítricos.
Figura 1
El D-limoneno es un solvente biodegradable, con interesantes
propiedades químicas, agradable aroma y calificado como seguro y ecológico. Es
usado como disolvente de resinas, pigmentos,
tintas,
pinturas, en la fabricación de adhesivos,
como aditivo en fragancias, etc. Es utilizado por las industrias farmacéuticas
y alimentarias como aromatizante y para dar sabor. Además es
empleado como insecticida ya que no es tóxico para los seres
humanos y animales domésticos, ni perjudicial para la jardinería ni para el
medio ambiente.
En la industria, los aceites esenciales son aislados a
partir de distintos métodos, los cuales se muestran en la Figura 2.
Figura 2
Tradicionalmente, los aceites esenciales han sido
extraídos a través de destilación por arrastre con vapor de agua o por
extracción con solventes orgánicos. Durante las dos últimas décadas, se han
realizados enormes esfuerzos para la utilización de CO2 líquido o
supercrítico en lugar de solventes orgánicos. El CO2 es útil como un
solvente alternativo verde porque presenta amplias ventajas ya que, no es
inflamable, relativamente no tóxico, fácilmente disponible y ambientalmente
benigno. A pesar de ser considerado como un gas de efecto invernadero, cuando
es utilizado como un solvente es capturado de la atmósfera, no generado, no
resultando en un daño para el medio ambiente. Sus propiedades, baja toxicidad y
fácil remoción del medio de reacción han hecho posible el desarrollo de
tecnologías basadas en la utilización de CO2 para la extracción de
varios productos alimenticios, incluyendo aceites esenciales y para el
descafeinado de café y té. Además, otro gran beneficio del empleo de CO2 como
solvente es la accesibilidad a los cambios de fase. A diferencia de otros
gases, se necesitan relativamente bajas temperatura y presión para formar CO2
líquido y supercrítico.
Materiales:
-
Cáscara de
naranja
-
Alambre de cobre
(20 cm)
-
Rallador de
cocina
-
Papel de filtro
(círculo de 1,5 cm de diámetro)
-
Tubo de
centrífuga de plástico con tapa a rosca
-
Tubo o cilindro
transparente de plástico
-
Hielo seco picado
-
Agua caliente
(entre 40-50 ºC)
-
Pinza
-
Termómetro
-
Espátulas
Procedimiento:
1. Preparación de la cáscara de naranja: rallar solamente
la parte coloreada de una naranja y pesar aproximadamente 2,5 g.
2. Preparación del tubo de extracción: Utilizando alambre
de cobre y el círculo de papel de filtro armar la trampa para sólidos como se
muestra en la Figura 3. Colocarla dentro del tubo de centrífuga. Agregar 2,5 g aproximadamente
de cáscara de naranja rallada sin empaquetarla demasiado.
3. Preparación del ambiente de extracción: llenar el tubo
de plástico hasta 2/3 de su capacidad con agua caliente (40-50 ºC).
4. Extracción: llenar el resto del tubo de centrífuga con
hielo seco molido (RECORDAR: NO OLVIDAR USAR GUANTES). Tapar el tubo con la
tapa a rosca hasta el final. (PRECAUCIÓN: si el tubo queda mal cerrado la tapa
puede salir despedida en medio de la experiencia. Por este motivo, no se debe
colocar nada sobre el cilindro y NO OLVIDAR USAR GAFAS DE SEGURIDAD).
5.
Inmediatamente,
colocar el tubo de centrífuga en el cilindro conteniendo el agua caliente.
6. Después de 15 segundos, el CO2 líquido
debería aparecer. Si no aparece después de 1 minuto, significa que el tubo no
está suficientemente cerrado. Sacarlo del cilindro de plástico, ajustar la tapa
y colocarlo nuevamente en el agua.
7. Mientras el líquido hierve, pasa a través de la
cáscara hacia el fondo del tubo (RECORDAR: NUNCA SACAR EL TUBO DE CENTRÍFUGA
DEL CILINDRO CON AGUA CUANDO EL CO2 ESTÁ LÍQUIDO).
8. Una vez que el líquido se ha evaporado y el gas
terminó de escapar, quitar el tubo del cilindro plástico y destapar lentamente.
9. El producto, un aceite amarillo pálido, debería
aparecer en el fondo del tubo cuando la extracción está completa.
Figura 3
Experiencia nº 2:
“Oxidación de alcoholes”
Objetivo:
Oxidar un alcohol en ausencia de solvente y
empleando microondas como fuente de activación.
Principios de Química Verde considerados:
-
Solventes
seguros: el empleo de solventes debería ser innecesario cuando ello fuese
posible.
-
Diseño para una
eficiencia energética: los requerimientos de energía deberían ser
considerados por su impacto medioambiental y económico y deberían ser
minimizados.
Consideraciones teóricas:
Una de las reacciones más
valiosas de los alcoholes es la oxidación para generar los correspondientes
compuestos carbonílicos. Existen un gran número de reactivos que permiten
efectuar esta transformación química entre los que se incluyen KMnO4,
CrO3, Na2Cr2O7, etc. La elección
del agente oxidante depende de factores como costo, conveniencia, rendimiento
de la reacción, sensibilidad del alcohol, etc. Así, el MnO2 es un
reactivo muy utilizado en química orgánica para la oxidación selectiva de alcoholes
alílicos y bencílicos. El MnO2 puede usarse soportado sobre algún
material inorgánico.
Uno de los avances importantes
en el campo de la síntesis orgánica es el desarrollo de reactivos soportados en
materiales inorgánicos. La adsorción de los reactivos y productos en estos
materiales inorgánicos no solo influye en la reactividad y selectividad sino
que además simplifica considerablemente los problemas asociados con su manejo y
separación en el laboratorio. Entre los materiales utilizados como soporte se
encuentran las arcillas bentoníticas, las cuales son minerales de origen
natural. Desde el punto de la química verde, el empleo de este tipo de
sustancias es muy importante, ya que las mismas no generan riesgos al
medioambiente.
La reacción que
se estudiará en este trabajo práctico consiste en la oxidación de alcohol
bencílico empleando MnO2 soportado sobre bentonita para obtener
benzaldehído. Este producto es intermediario en elaboraciones industriales de
colorantes, medicamentos y perfumes. La reacción se llevará a cabo empleando
microondas (MO) como fuente de activación (Figura 4).
Figura 4
Un factor importante que
debe ser tenido en cuenta al diseñar un proceso verde consiste en evaluar los
requerimientos energéticos de las reacciones químicas involucradas, siendo
preferibles aquellos sistemas que permitan minimizar el consumo de energía. El
empleo de radiación de microondas ha sido empleado en las últimas décadas para
disminuir los tiempos de reacción de diversas transformaciones químicas con un
mejor aprovechamiento energético.
Materiales:
-
Alcohol bencílico
-
MnO2/bentonita
-
Vasos de precipitado de 50 y 100 mL
-
Lana de vidrio
-
Jeringa de 1 mL
-
Vidrio de reloj
-
Microondas
-
Erlenmeyers de 50 mL
-
Embudo
-
Papel de filtro
-
Espátula
-
Cuba cromatográfica: hexano/acetato de etilo 60:40,
placas cromatográficas y capilares.
Procedimiento:
1.
Pesar 0,5 g de MnO2/bentonita en vaso de
precipitado de 50 mL y esparcir homogéneamente el sólido en toda la superficie
del vaso.
2.
Agregar de manera homogénea 0,2 mL de alcohol
bencílico sobre el MnO2/bentonita.
3.
Colocar la lana de vidrio en el vaso de precipitado
de 100 mL y luego introducir en este el vaso de 50 mL conteniendo la mezcla de
reacción. Tapar el sistema con el vidrio de reloj.
4.
Someter la mezcla anterior a irradiación con
microondas durante 3,5 minutos a 458W.
5.
Retirar la mezcla de reacción del microondas y llevarla
bajo campana. Dejar enfriar.
6.
Enjuagar el vidrio de reloj con acetona vertiendo el
contenido en un erlenmeyer.
7.
Adicionar a la mezcla de reacción irradiada 10 mL de
acetona, agitar bien. Filtrar con papel de filtro en un erlenmeyer.
8.
Identificar el producto de la reacción por CCD
(cromatografía en capa delgada) comparativa, eluyendo en un sistema
hexano/acetato de etilo 60:40. Revelar empleando luz UV y p-anisaldehído en medio ácido.
Análisis de los resultados
Mediante CCD
comparativa se puede hacer un seguimiento de la reacción de oxidación,
permitiendo determinar la presencia y/o ausencia de material de partida y
producto. Sin embargo, esta técnica no permite cuantificar el avance de la
reacción. Una herramienta muy útil para realizar un análisis cuantitativo de
ello lo constituye la Resonancia Magnética Nuclear de Protón (RMN 1H).
En la Figura 5 se muestra el espectro de
RMN 1H del material de partida (alcohol bencílico) y en la
Figura 6 el espectro de una mezcla de reacción irradiada en las mismas condiciones
ensayadas en este práctico (durante el desarrollo del trabajo práctico se
analizarán detalladamente los espectros obtenidos).
Figura
5
Figura
6
miércoles, 20 de agosto de 2014
CAMBIO DE AULA
Se informa que el dictado la clase del día miércoles 20 de agosto se llevará a cabo excepcionalmente en el Aula 3
martes, 12 de agosto de 2014
Inicio de Clases
La asignatura Introducción a la Química Verde se dictará los días miercoles de 16:30 a 18:30 h. en el aula 12 (anfiteatro).
Inicio 13-08-2014
Inicio 13-08-2014
martes, 22 de julio de 2014
CURSADO 2014 REUNIÓN DE COORDINACIÓN DE HORARIOS
El día lunes 11 de agosto de 2014 a las 17 h. realizaremos una reunión en el Aula de Graduados para coordinar los horarios de cursado de la asignatura.
Invitamos a todos los alumnos que cursarán la asignatura a participar de la misma.
Invitamos a todos los alumnos que cursarán la asignatura a participar de la misma.
jueves, 6 de febrero de 2014
Suscribirse a:
Entradas (Atom)